撰文 | 黄雨佳
审校 | clefable
我们对于癌症的第一印象往往是:无恶不作,疯狂生长。其实,恶性肿瘤之所以能在体内发展壮大,除了癌细胞拥有快速分裂的能力外,还有一个重要因素是癌细胞能巧妙地骗过机体的免疫系统,让身体误以为癌细胞是正常细胞,或是抑制免疫系统,让原本打算上阵杀敌的免疫细胞变得“安分守己”。
一团“异类”细胞在体内疯狂生长,不知道这种描述是否会让你联想到另一个场景——怀孕。对于孕妇而言,胎儿同样是“异己”的存在。而胎儿之所以能在孕妇体内存活几个月之久并不断生长,正是因为在怀孕期间,孕妇的免疫系统也会做出相应改变。而如果孕妇的免疫系统开始攻击胎儿,就可能出现很可怕的后果,例如流产、死胎或新生儿死亡。
这样看来,癌症和怀孕之间似乎确实存在某种共性。在最近发表于《细胞》(Cell)的一篇论文中,来自美国密歇根大学(University of Michigan)的科学家证实,癌症和怀孕之间的确存在共同的免疫耐受机制。
免疫耐受的幕后推手
为了弄清楚人类癌症和母胎界面中的细胞中究竟发生了什么,研究人员找到了多种人类肿瘤微环境(TME)和胎盘的单细胞RNA测序结果,这种数据能表征每个细胞中不同蛋白质的表达情况。通过交叉分析这些数据,特别是着重分析肿瘤细胞和滋养层细胞(早期胚胎最外层的一层细胞,与母体子宫内膜共同形成母胎界面)中“异己”的成分后,研究人员发现一种名为B7-H4的分子在肿瘤微环境和胎盘中都会大量表达。
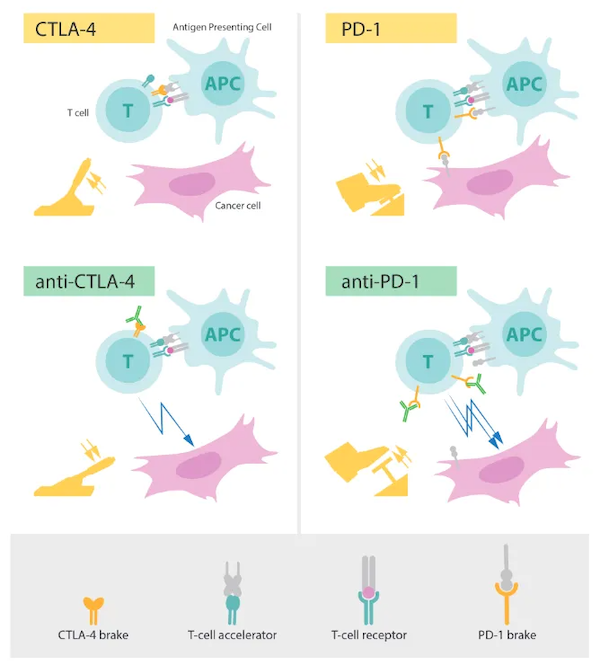
为了严格控制T细胞只杀敌人而不误伤正常的组织和细胞,并且能在T细胞过度工作时及时地让它冷静下来,我们的身体有一套活化和抑制T细胞的机制,就像汽车的油门和刹车一样。当T细胞上表达的相应受体(例如PD-1或CTLA-4分子)接收到外界的抑制性信号(例如另一个细胞表面的PD-L1或B7-1分子)时,就会启动一系列级联反应,抑制T细胞活化。B7-H4类似于PD-L1或B7-1,是一种免疫检查点(immune checkpoint)分子,充当着免疫反应守门人的角色。
研究人员发现,不同类型的细胞会广泛表达抑制性的PD-L1,与之不同,B7-H4主要在癌细胞和母胎界面的滋养层细胞中表达。此前的研究同样表明,羊膜(包绕胚胎的最内层的胎膜)细胞也会表达B7-H4。而且,不仅人胎盘中会高表达B7-H4,像小鼠这样的哺乳动物的胎盘中也有同样的表达模式。因此,研究人员推测这种分子可能是孕妇免疫系统不会攻击胎儿的原因之一。
为了验证这个想法,研究人员通过基因改造获得了不表达B7-H4分子的雌性小鼠。结果显示,这种小鼠怀胎数量与正常小鼠无异。但是,如果它是与普通小鼠(即野生型)杂交怀孕,腹中胎鼠在子宫内死亡和被吸收的情况就会显著增加;而如果它是与同样的基因改造小鼠繁育后代,则不会出现这种情况。这说明,B7-H4在同种异体交配相关的免疫激活过程中扮演了重要的调控角色。
实验结果表明,怀孕期间,滋养层中的绒毛外滋养细胞(EVT)会表达B7-H4分子,母体的细胞毒性T细胞(即CD8+ T细胞)可能正是与这些细胞相互作用后出现耗竭,因而无法攻击胎儿。
此时,B7-H4分子的一个特点引起了研究人员的注意。B7-H4分子不仅会在滋养层细胞和癌细胞中高表达,还特别会在女性生殖器官相关的癌细胞中高表达。例如,研究人员在乳腺癌和卵巢癌细胞中都观察到了B7-H4高表达的现象。这让研究人员提出了一个假设:会不会女性体内的激素与细胞表达B7-H4相关呢?女性激素是否是保护胎儿,但同时又是导致妇科癌症免疫耐受的“双刃剑”呢?
于是,研究人员测试了乳腺癌细胞对三大类女性激素的反应,包括性激素(例如雌激素和孕酮)、妊娠相关激素(例如人绒毛膜促性腺激素和人胎盘催乳素)以及月经周期相关激素(例如黄体生成素和卵泡刺激素)。结果显示,这些激素中唯独孕酮会显著导致癌细胞上调B7-H4分子的表达。在人滋养层细胞和人子宫内膜上皮细胞中的实验也显示出了同样的结果。可见,孕酮是女性母胎界面和乳腺癌出现免疫耐受的背后推手之一,它会促进乳腺癌的发生发展。
抑制免疫检查点
虽然免疫检查点分子是保障我们机体正常工作的重要机制,也是保护孕妇体内胎儿不受免疫系统攻击的重要帮手。但是,一旦这种免疫系统的“刹车”被癌细胞利用,人体就可能出现问题:如果癌细胞也表达像B7-H4这样的抑制T细胞活化的分子,并且与T细胞上的相应受体结合,T细胞就无法活化并杀死癌细胞了。
研究癌症的科学家早已意识到这一问题。于是,如何避免“刹车”发挥功能、重启失效的免疫系统成了科学家的研究方向。20世纪90年代,美国免疫学家詹姆斯·P.艾利森(James P. Allison)和日本免疫学家本庶佑(Tasuku Honjo)分别发现了T细胞上的两种刹车分子——CTLA-4和PD-1。艾利森还发现,如果用抗体阻断CTLA-4与抑制性信号相互作用,就能重启T细胞的肿瘤杀伤活性,这种阻断免疫检查点的分子又被称为免疫检查点抑制剂(ICB)。两位科学家也于2018年获得了诺贝尔生理学或医学奖。
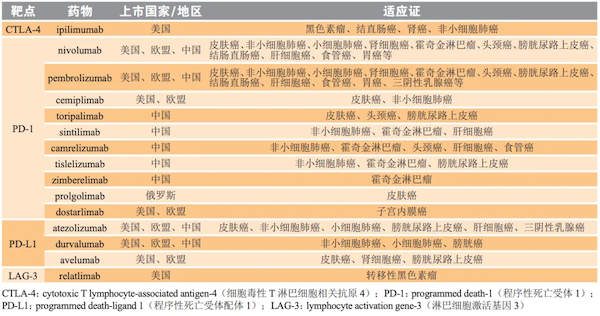
2011年,伊匹单抗(Ipilimumab)被美国食品和药品管理局(FDA)批准上市,用于治疗晚期黑色素瘤,成为首个获批的CTLA-4单抗。2014年,美国FDA又批准了纳武利尤单抗(Nivolumab),这也是首个获批的PD-1单抗。十几年来,越来越多针对不同免疫检查点分子的药物陆续上市,适应症也越来越广泛。
然而,针对像乳腺癌和卵巢癌这样的妇科癌症,这些免疫检查点抑制剂的效果并不好。因此,这篇新研究也让科学家意识到,既然B7-H4分子是这些癌症中重要的免疫检查点分子,那么阻断这条抑制通路或许能有助于治疗妇科癌症。实验结果证明,如果使用药物降低B7-H4分子的表达,同时辅助使用抗PD-L1等免疫检查点抑制剂疗法,就能很好地抑制乳腺癌的发展。
这条癌症和怀孕背后共同的免疫耐受通路,或许已经为开发妇科癌症疗法打开了一扇全新的大门。
参考来源:
https://www.cell.com/cell/fulltext/S0092-8674(24)00652-4
https://www.nobelprize.org/uploads/2018/10/press-medicine2018.pdf
张文欣, et al. “免疫检查点抑制剂的研究进展.” 药学进展 46.12 (2022): 910-921.
